性阻害によって収縮環におけるミオシン とアクチンの to が上昇して両者の秩序が保てなくなり,その結果収縮 速度の低下が見られたと我々は考えた13). 最近,ミオシン は収縮環領域全体の張力の発生新着細胞生物学用語集 (アクチン・ミオシン(阻害剤)) ミオシンII阻害剤 (blebbistatin, Y, ML7など) Myosin inhibitors (blebbistatin, Y, ML7) 米村 重信 理化学研究所 発生・再生科学総合研究センター (CDB) お問合せ Blebbistatinには鏡像異性体の ()体と ()体と この束の収縮は,タンパク線維の分子が縮むのではなくて, 横に並んだ ミオシン(myosin) と アクチン(actin) という2種類のタンパク線維(フィラメント)の位置関係が動く(滑る) ことによって生じる。
1
アクチン ミオシン アクトミオシン
アクチン ミオシン アクトミオシン-このミオシンVの安定したアクチンフィラメントへの結合が、ミオシンVのアクチンフィラメント上での連続運動を可能にしてると推測出来 ます。 参考文献 Komori et al BioSystems 08 Komori et al Biophysical J 09 Nishikawa, Komori et al Single measurement techniques 07アクトミオシンあくとみおしんactomyosin アクチン と ミオシン の結合体。 新鮮な筋肉のひき肉を、濃い 塩化カリウム 溶液で抽出し、注射器で水の中に押し出すとゼリー状の紐 (ひも)ができる。 これは天然のアクトミオシンであるが、これに ATP (アデノシン三リン酸)を加えるときゅっと縮まる。 すなわち、 ATPアーゼ 活性を示す。 この現象は1942年ハンガリーの




筋収縮のメカニズム と アクチン ミオシン の覚え方
こんにちは。山形元気です。 ご覧いただきありがとうございます。 さて。 今日は、 「筋肉を動かすアクチンとミオシン」 を説明していきます。 今日の内容は結構重要です。 どのように筋肉に動きが起こるのか。 これを解説していきます。ミオシンv が一度アクチン線維に結合すると,解 離するまでにatp 加水分解反応を複数回行いながら アクチン線維上を移動することが1999年に示された2) (現在はミオシンv のクラスの中でも1 回の加水分解 反応サイクル中にアクチン線維から解離してしまう種In vitro における収縮環の収縮はミオシンIIに依存するがアクチンのダイナミクスには依存しない 柏﨑 隼・高木智子・馬渕一誠 (学習院大学理学部 生命科学科分子細胞生物学) email: 馬渕一誠 DOI /firstauthor In vitro contraction of cytokinetic ring
121 アクチン・ミオシンモデルの先行研究 筋収縮モデルは1957 年、A F Huxley らによって提唱されたCrossBridge モデルから 始まり、その後、様々な研究者によって発展されてきた。Huxley らは心筋全体の収縮を代 表する一つのアクチンサイトとミオシンヘッドの相互作用によるものとしアクチン・ミオシンというと筋肉細胞を思い出す方も多いと思います。しかし実はすべての真核細胞 において、欠かすことのできない重要な役割を果たしていることが近年わかってきました。細胞のいわば "骨" や"筋肉" の役割をはたす、このようなシステムを一般的に「細胞骨格」と呼び図1 アクチンとミオシンの会合・解離サイクルとensemble force Fe:ensemble force f:intrinsic force of crossbridge tc:アクトミオシンの結合・解離サイクルのtotal cycle time ts:強い結合状態時間(time of strongly bound state) duty ratio=ts/tc OM:omecantiv mecarbil 52 消ケ会 O ê z Ý 22 Ò ·19 k8 0 FHのコンバータードメイン
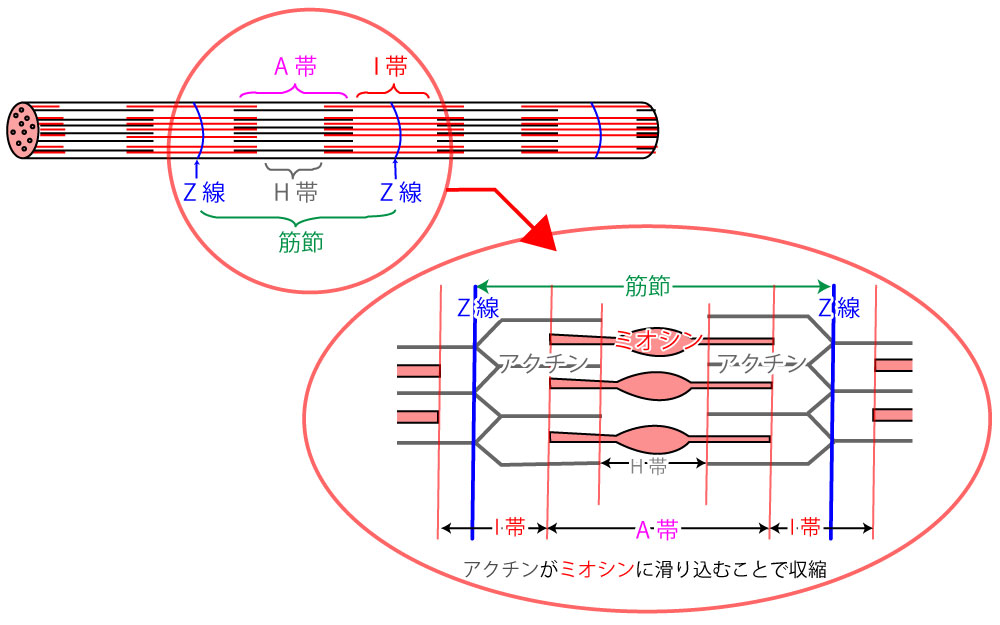
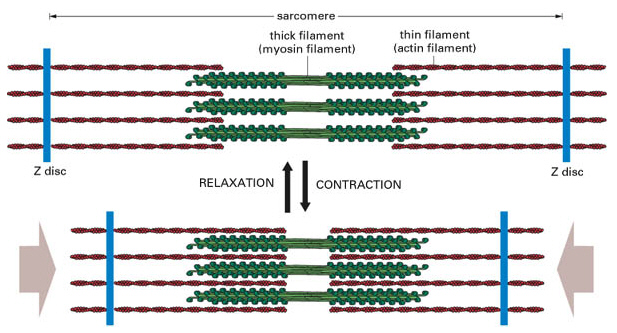
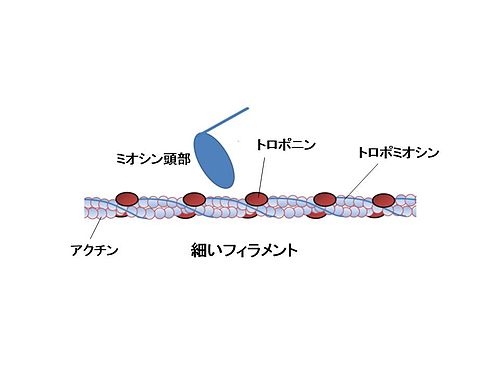
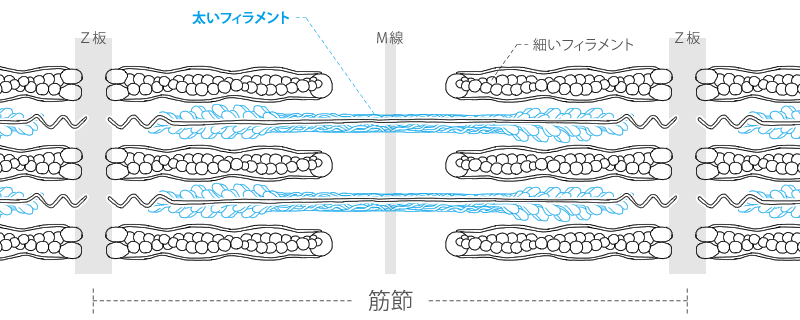
アクチンフィラメントとミオシンフィラメント 筋原線維は筋収縮に重要なミオシンフィラメントとアクチンフィラメントを内包した細胞内の小器官であり、2つのZ板の間の筋収縮の最小単位である 筋節(サルコメア) の繰り 返しによって形成されているミオシン球状頭部は、「ロープ」として作用するアクチンの細いフィラメントとの相互作用を媒介する横方向の架橋を形成する。 収縮の現象は2つの段階に分けることができます。 1)太いフィラメントと細いフィラメントとの間の結合(クロスブリッジの形成)。 2)フィラメントスライディング 述べたように、架橋の形成は繊維内部のカルシウムの活性の増加に依存アクチン、ミオシン、アクトミオシン 繊維状で筋肉の収縮に関与 加熱することで収縮し、硬くなる 筋形質たんぱく質 ミオグロビン、酵素など 解糖酵素を含む ミオグロビンは魚肉の血合い肉 結合組織たんぱく質 コラーゲン 加熱によって凝固




高校生物 筋肉の張力のグラフと計算の問題の解き方を解説 高校生物の学び舎



1
主な違い アクチンとミオシン 筋肉はタンパク質で構成されています。 アクチンとミオシンは筋肉内の2つのタンパク質で、動物の筋肉収縮に関与しています。 それらは、トロポミオシン、トロポニン、およびメロミオシンとして知られる調節タンパク質と協調して身体の自発的な筋肉の動きを制御します。 アクチンおよびミオシンタンパク質は、筋原線維に縦 ミオシンとならび長く研究されているアクチン結合タンパク質であるFilamin Aはアクチン線維どうしの架橋にかかわる(図4a).Filamin AはそのN末端側でアクチン線維と結合し,二量体を形成することによりアクチン線維を架橋する 18) .この架橋により,アクチン線維は網目状の構造をとりゲル状アクチン・ミオシン聞の硬直結合がca2 処理によって 遊離するノマラトロポミオシンによって脆弱になることを 支持する結果を得たので報告する。 il 実験材料および方法 1 筋肉および筋肉モデルの調製 家兎の胸最長筋と大腰筋を供試した。筋線維束は家兎 大腹筋からszent 司gyorgyiの方法的に




古寺 哲幸氏 動くミオシンの撮影に成功 Nature 著者インタビュー Nature Nature Portfolio




筋肉が動くしくみとは 横浜市保土ヶ谷区のcortisパーソナルトレーニングジム
そこで筆者らの研究では,天然ミオシンとミオシンロッド のモル比を1:2にして混合した溶液でミニフィラメント を合成し,最大で6分子程度がアクチンと相互作用できる 条件で,低ATP 濃度(20M)における変位・力計測を 行った9).この条件で,アクチンの片端にビーズを結合さ せてミオシンフィラメントと相互作用させると,図7a に 示すように12pN 程度まで連続的に力を太いフィラメント(ミオシンフィラメント,Thick filament) 細いフィラメント(アクチンフィラメント,Thin filament) なるフィラメントが存在します. これらのフィラメントがお互いに滑り込むことによってサルコメアの長さが短くなります. アクチンの解重合を提唱した。しかし,加圧ゲルの形成条 件やゲル形成を維持する化学結合,微細構造などその詳細 ミオシンを沈殿させた後,遠心分離(900×g)しアクトミ オシンを分離した。分離したアクトミオシンは再度KCl 濃度を06 Mに調整し,遠心分離(900×g)し,上清を採



アクチンとミオシン




筋原線維 ミオシンとアクチンの構造 筋節 A帯 I帯 H帯 Z帯 Youtube
筋原線維タンパク質は主にアクチンとミオシンから構成されています。 これらは塩溶性のタンパク質であり、塩類の添加により溶出し保水性が向上します。 特にミオシンが肉の保水性や結着性の向上に大きく影響すると言われてます。 これは加熱によるミオシンのゲル化を介して肉の組織同士ミオシン頭部にはアクチンとの結合部位とatp 分解酵素の働きがある。 はじめミオシン頭部は、こぶしをつくって腕を曲げたような形でアクチンと結合してい る。atp がやってくると、atp はミオシン頭部のatp 分解酵素部位と結合する(下図1)。ミオシン,アクチン,トロポミオシンおよびトロポニンはともに,筋繊維の蛋白質の 3/4 以上を占める。その他 種ほどのタンパク質が含まれる。これらのタンパク質はサルコメア( 筋節 )中の筋繊維の組織化に関わり,また細胞膜および細胞外基質へ筋節を結合させるのに働いている。これ



Spring 8放射光により解明された筋収縮蛋白ミオシンの意外な振舞 トピック Spring 8 Web Site




筋節の構造 アクチンとミオシン Web系エンジニアを医学生が目指してみる
ミオシンみおしんmyosin 筋肉 を構成する タンパク質 の一つで、1942年セント・ジェルジーによって単離された。 アクチン とともに、筋原線維(筋線維内に多数縦走する円筒状の微細構造)の主要な構成要素で、ウサギの骨格筋では筋原線維タンパク質の50%前後を占める。 サルコメア(筋原線維中の線維方向にみられる繰り返しの単位)の太いA フィラメント (長新着細胞生物学用語集 (アクチン・ミオシン) アクチン細胞骨格は、負に帯電した細胞膜の直下において機能することから、酸性脂質(主にリン脂質)による直接的な制御を受けるのではないかと考えられてきた。 実際、試験管内において、イノシトールリン脂質PIP2を含む人工膜小胞(リポソーム)をカエル卵抽出液中に添加すると、「アクチンコメット」と呼ばれる



高校生物の質問です ミオシンはアクチンフィラメント上を歩き Yahoo 知恵袋
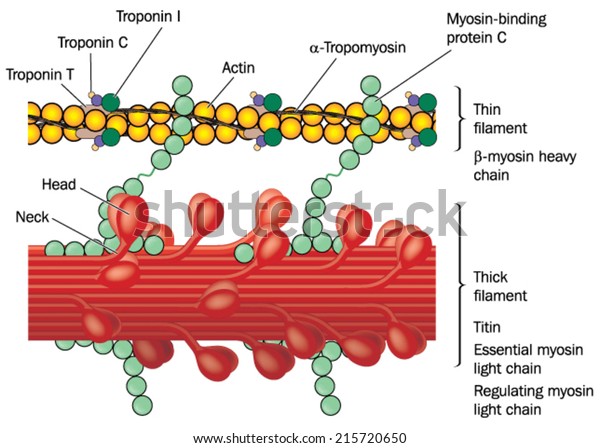



アクチン及びミオシン トロポニン複合体 細いフィラメント及び太いフィラメントを示す筋組織の詳細 Adobe Illustratorで作成 グラデーションメッシュを含みます Eps10 のベクター画像素材 ロイヤリティフリー



Www Fml T U Tokyo Ac Jp Img Graduation Thesis 16b Shimomura Pdf
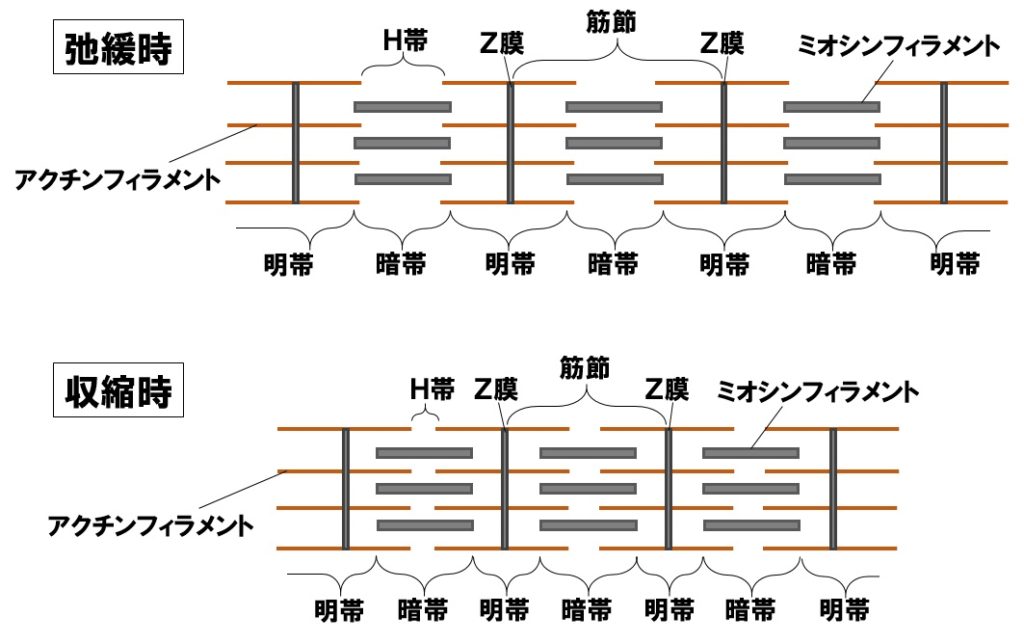



筋原繊維 筋収縮のしくみ 筋小胞体やトロポミオシンの動き Tekibo



トピックス 後口動物における筋肉の多様化 トロポニンとパラミオシンを指標とした研究 ウミユリの筋はトロポニン調節系を欠損し パラミオシンを保有しているー



ミオシンの柔道
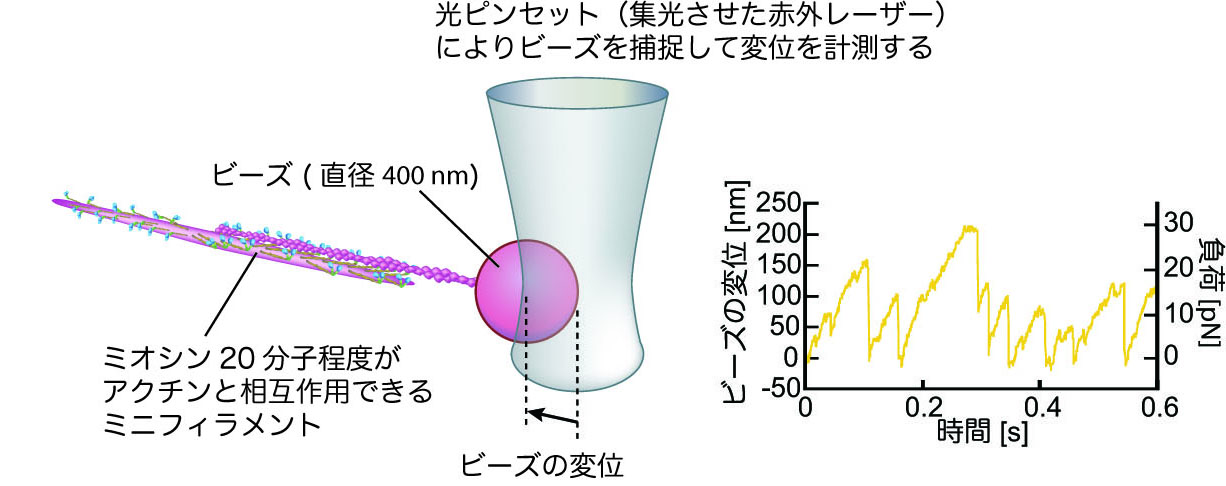



筋肉のタンパク質 ミオシンの協同的な力発生を発見 東京大学 大学院理学系研究科 理学部




基礎 塩と加熱が不可欠な練りもの 練りもの 教室 紀文アカデミー 紀文食品




アクチン ミオシン Sサイズ Laiman Stockweb メディカルイラスト素材のダウンロード販売



1
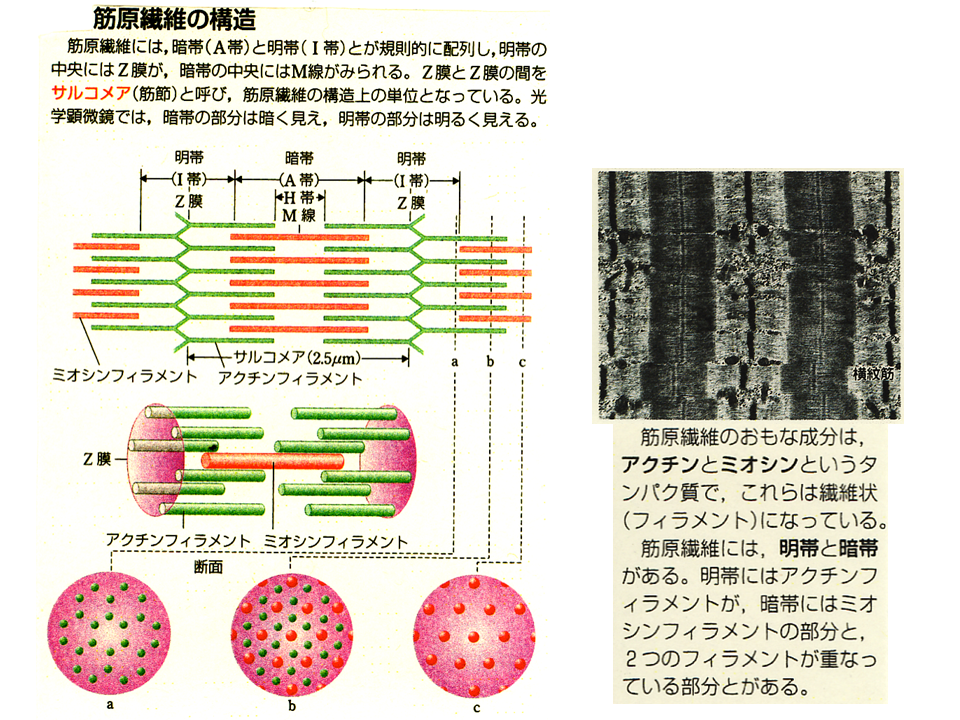



宮崎研究室筋肉の発生
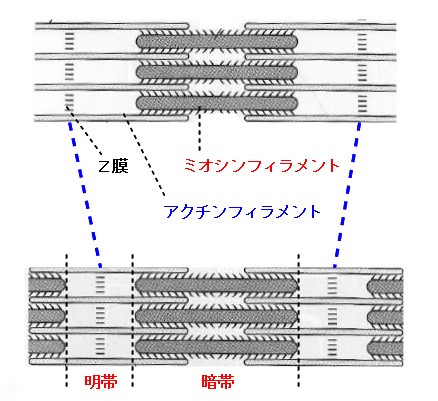



筋肉の構造と筋収縮の仕組み 筋原繊維とフィラメント
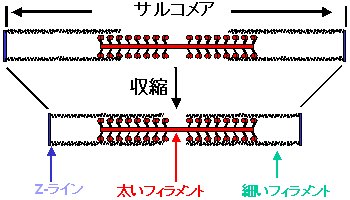



筋収縮のエネルギー変換機構を解明 すべての細胞運動 細胞内輸送に共通の機構が明らかに



Sts Home




筋収縮はどのようなメカニズムで収縮するのか 痛み取り専門 楽楽痛み研究会 公式サイト
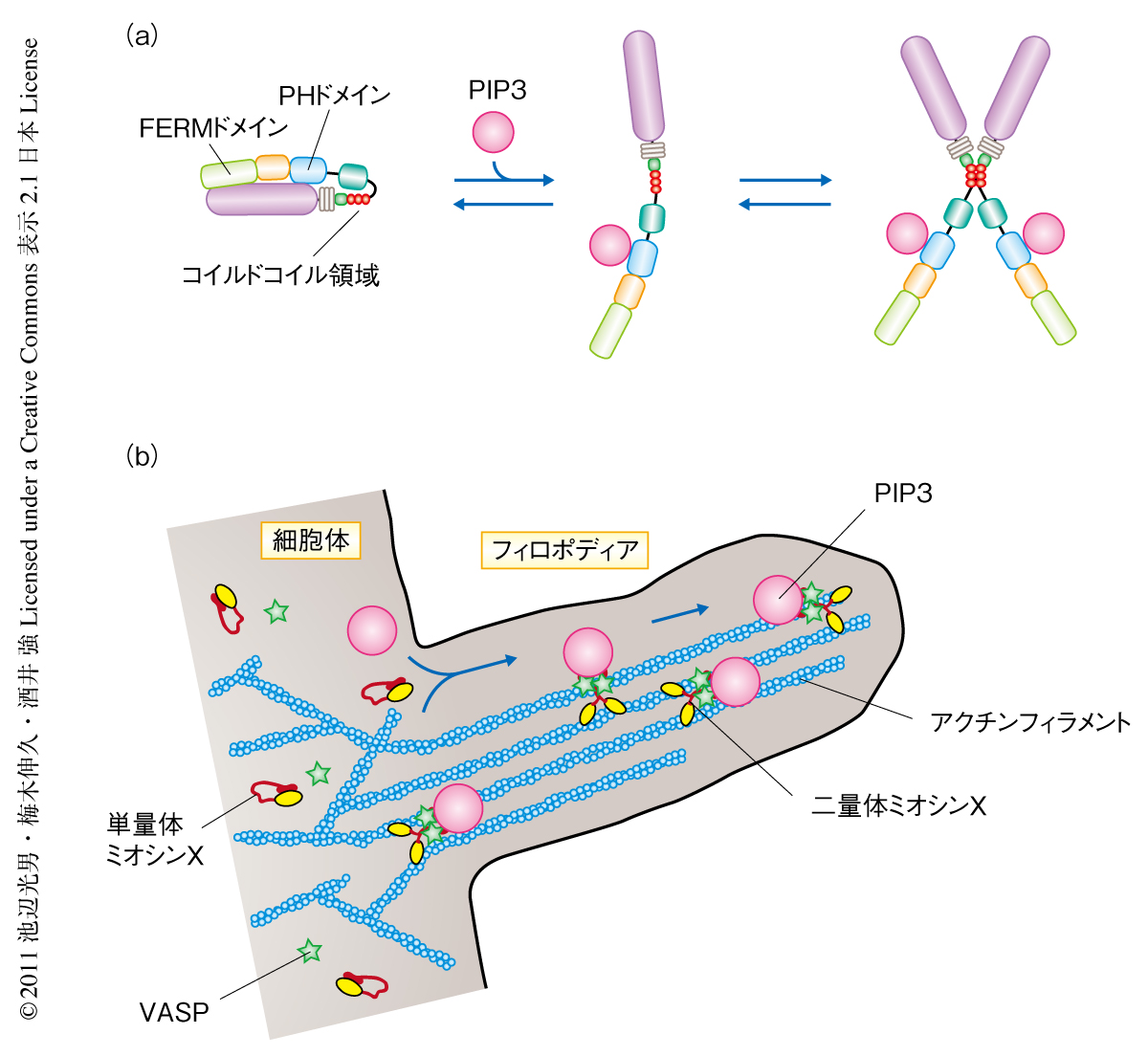



ミオシンxの物質輸送活性はリン脂質との結合により調節される ライフサイエンス 新着論文レビュー




筋のタンパク質 アクチン ミオシン



生体を動かすタンパク質
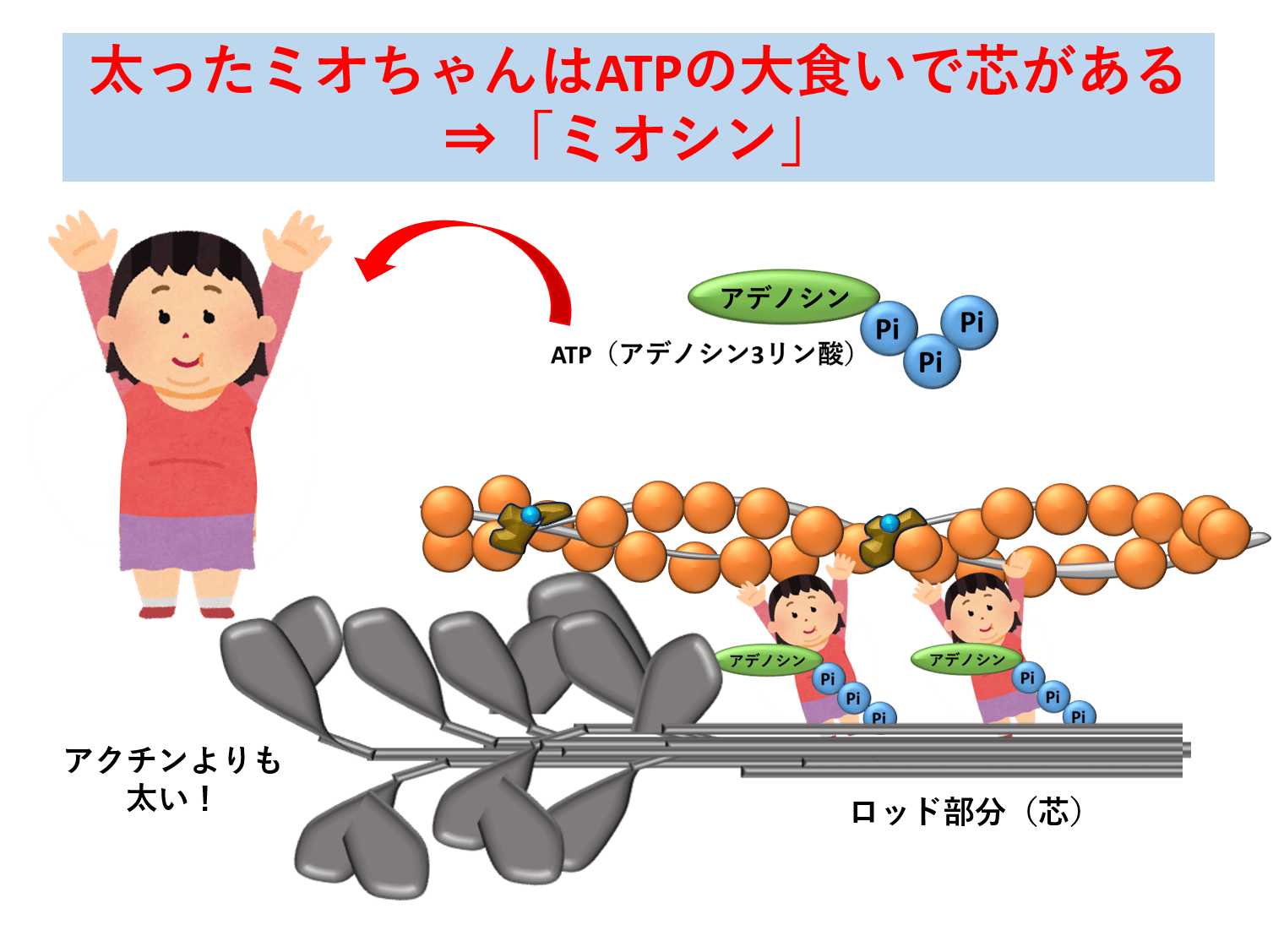



一発で覚える 筋収縮の仕組み 陸上競技の理論と実践 Sprint Conditioning



Sts Home




高校生物 収縮メカニズム 映像授業のtry It トライイット
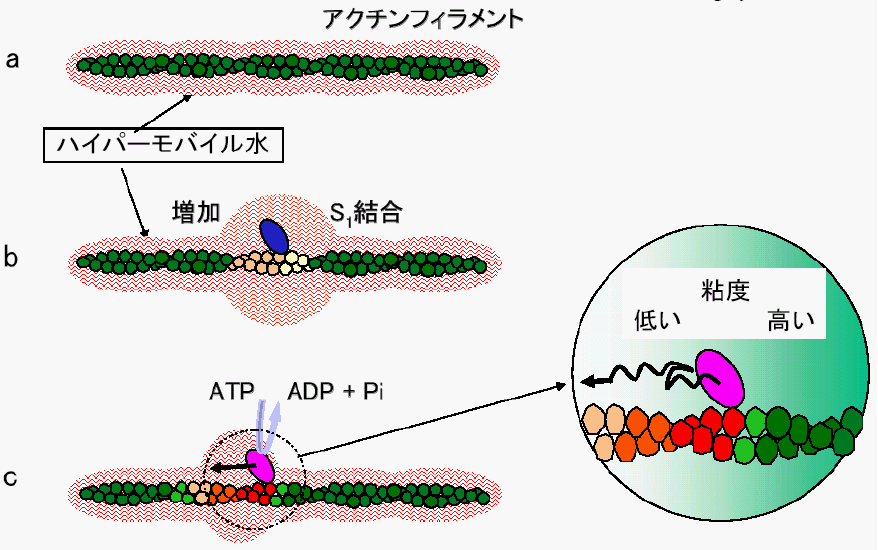



プレスリリース Mast21 東北大学 マテリアル 開発系




骨格筋の構造 動く 3 看護roo カンゴルー
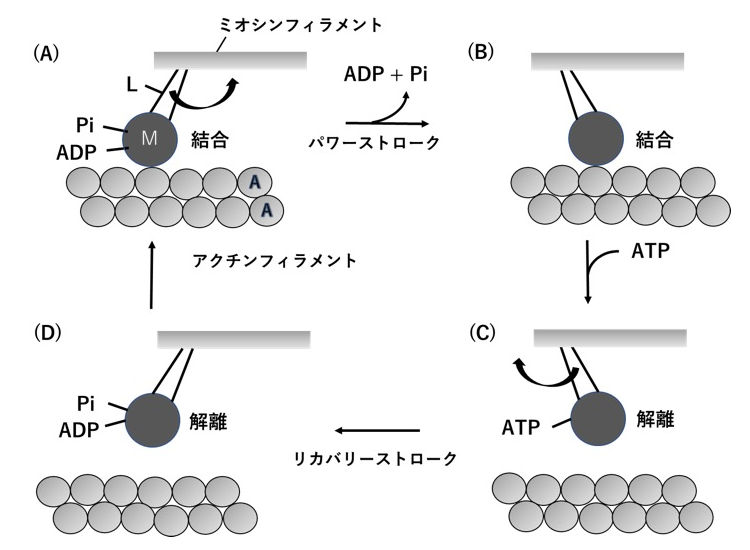



骨格筋収縮時のミオシン分子頭部とアクチンフィラメント間の硬直結合の構造に関する研究 Studies On The Structure Of Linkages Between Myosin Head And Actin Filament During Contraction In Skeletal Muscle Spring 8 Sacla 利用研究成果集




カブトガニの尾に隠されたパワー 微小筋肉の巨大な 力 のしくみ 杉 晴夫 ブルーバックス 講談社 2 2




高校生物 筋繊維の構造 映像授業のtry It トライイット
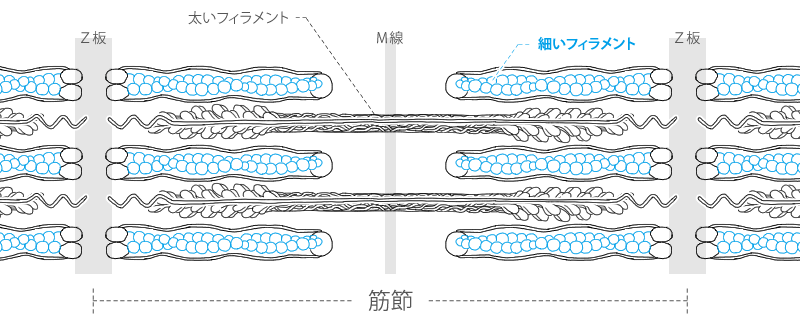



筋のタンパク質 アクチン ミオシン




ミオシンとは コトバンク



Signal



026 ミオシンとアクチンの相互作用 Interaction Of Myosin And Actin Gb 115b02 基礎医学教育研究会 Kikken Lab



筋肉の働き 滑り説とは バイオハックch




筋収縮のメカニズム と アクチン ミオシン の覚え方



筋肉痛になるのはなぜ 諸説あった



トロポニン Wikipedia




アクチンフィラメント系による細胞運動 筋収縮 Study Channel




生物 筋肉の筋細胞の筋原繊維の中にアクチンとミオシン Youtube




高校生物 明帯と暗帯 映像授業のtry It トライイット




Special Story 生命をささえる運び屋分子 Brh Jt生命誌研究館



生体 生命 資料 筋肉



筋のタンパク質 アクチン ミオシン




トリガーポイント発生のメカニズム やまだカイロプラクティック 鍼灸院ホーム ページ




5分でわかる ハックスレーの滑走説 筋が収縮する仕組みを現役大学院生が解説 ページ 2 2 Study Z ドラゴン桜と学ぶwebマガジン



一発で覚える 筋収縮の仕組み 陸上競技の理論と実践 Sprint Conditioning



Udruk51uy4d9ovrfkg1bb58e Biz Archives 731




骨格筋の構造 動く 3 看護roo カンゴルー



筋収縮を調節する分子メカニズムの一端を解明




アクチン




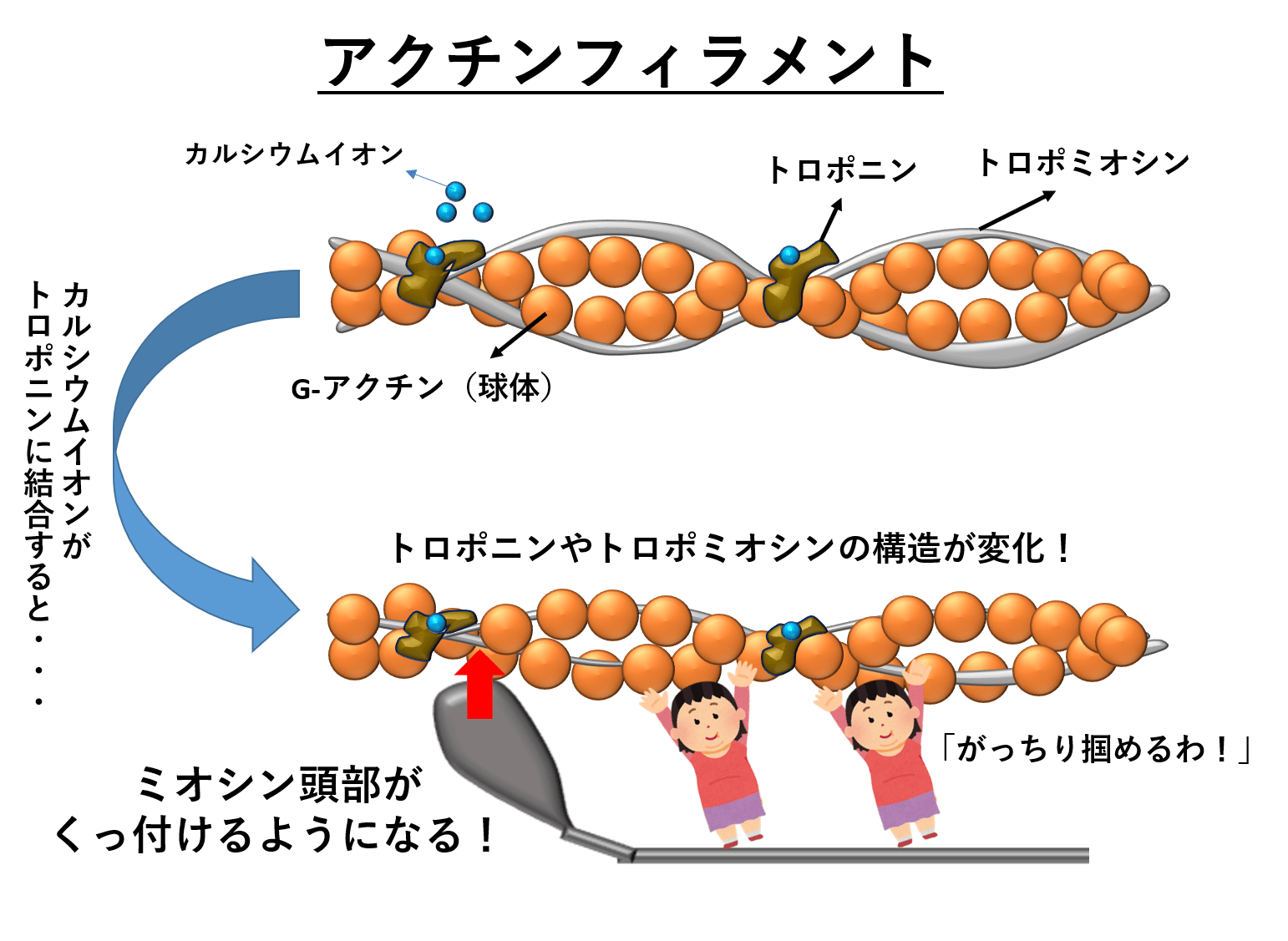
ヒポキャンパス در توییتر 筋収縮のメカニズム Ca濃度が上がる Caがtncに結合する Tniがアクチンから離れる トロポミオシンが アクチンの溝に移動する するとアクチンとミオシンがくっつく あとは首振り説に従ってatpを使って滑りまくる



Topic 5 心筋収縮のx線回折法による観察 Spring 8 Web Site




滑り説 Wikipedia
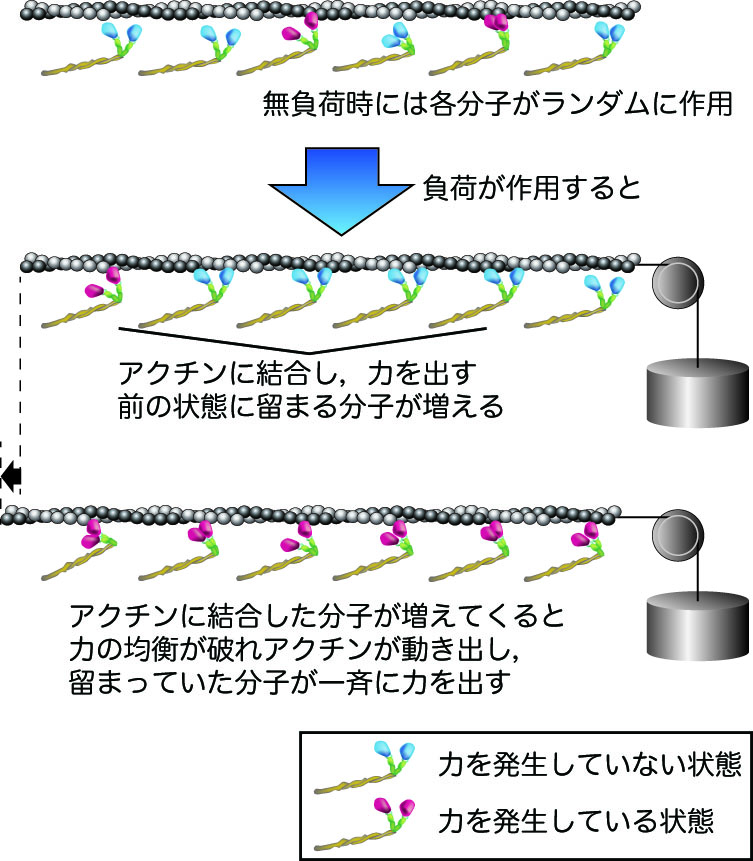



筋肉のタンパク質 ミオシンの協同的な力発生を発見 東京大学 大学院理学系研究科 理学部
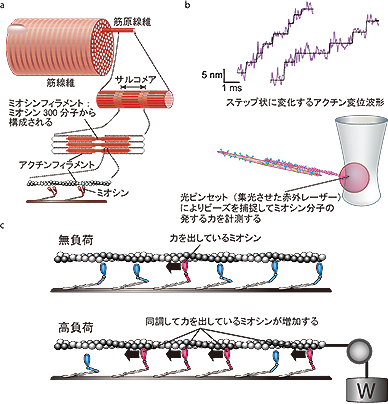



学部生に伝える研究最前線 筋のタンパク質ミオシン分子達は綱引きチーム 東京大学 大学院理学系研究科 理学部
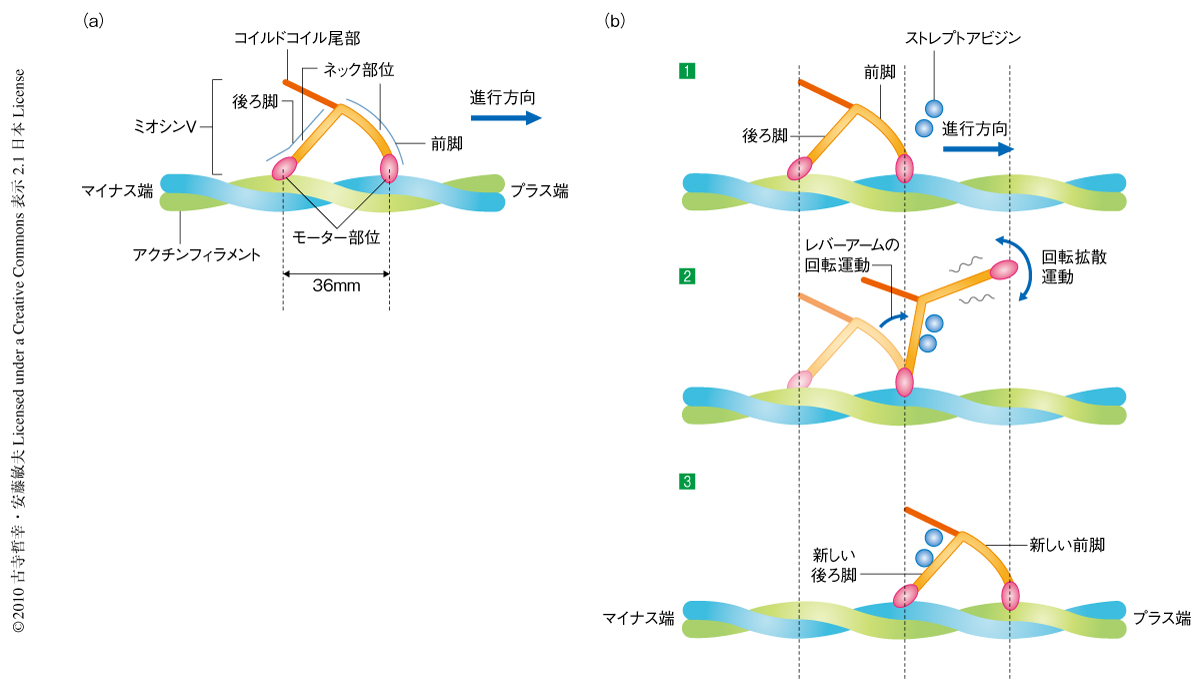



高速原子間力顕微鏡による歩行運動中のミオシンvのビデオイメージング ライフサイエンス 新着論文レビュー



高輝度x線回折により遺伝性骨格筋疾患の発症メカニズムを解明 少量の生検試料から診断が可能に プレスリリース Spring 8 Web Site
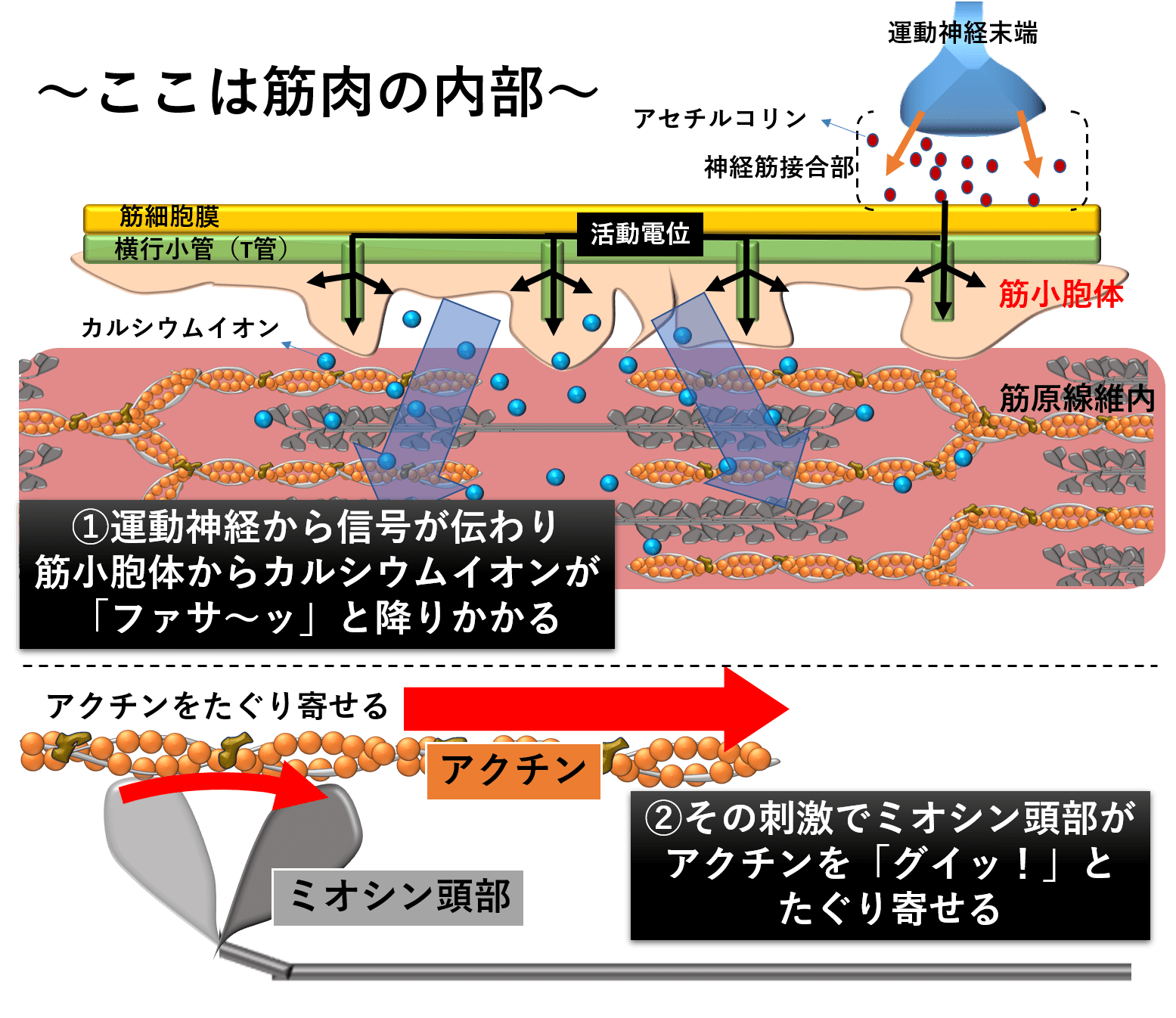



一発で覚える 筋収縮の仕組み 陸上競技の理論と実践 Sprint Conditioning
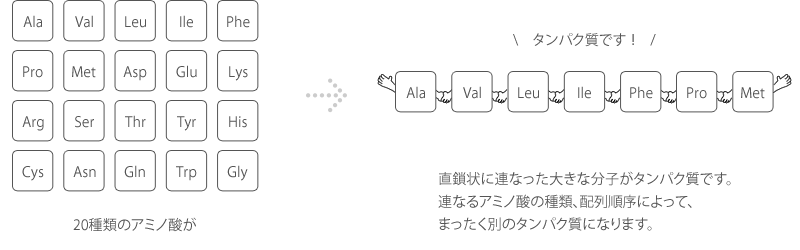



筋のタンパク質 アクチン ミオシン
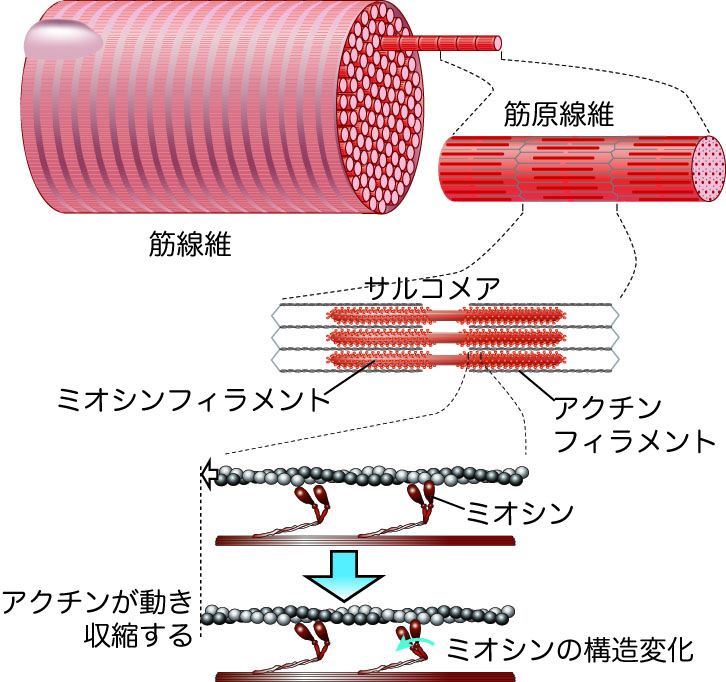



筋肉のタンパク質 ミオシンの協同的な力発生を発見 東京大学 大学院理学系研究科 理学部




筋収縮はどのようなメカニズムで収縮するのか 痛み取り専門 楽楽痛み研究会 公式サイト



Www Tmd Ac Jp Mri Cph Members Pdf Nikkei Actinmyosin Tf Pdf



収縮タンパク質 はどんな働きをする よくある質問 財団法人日本食肉消費総合センター
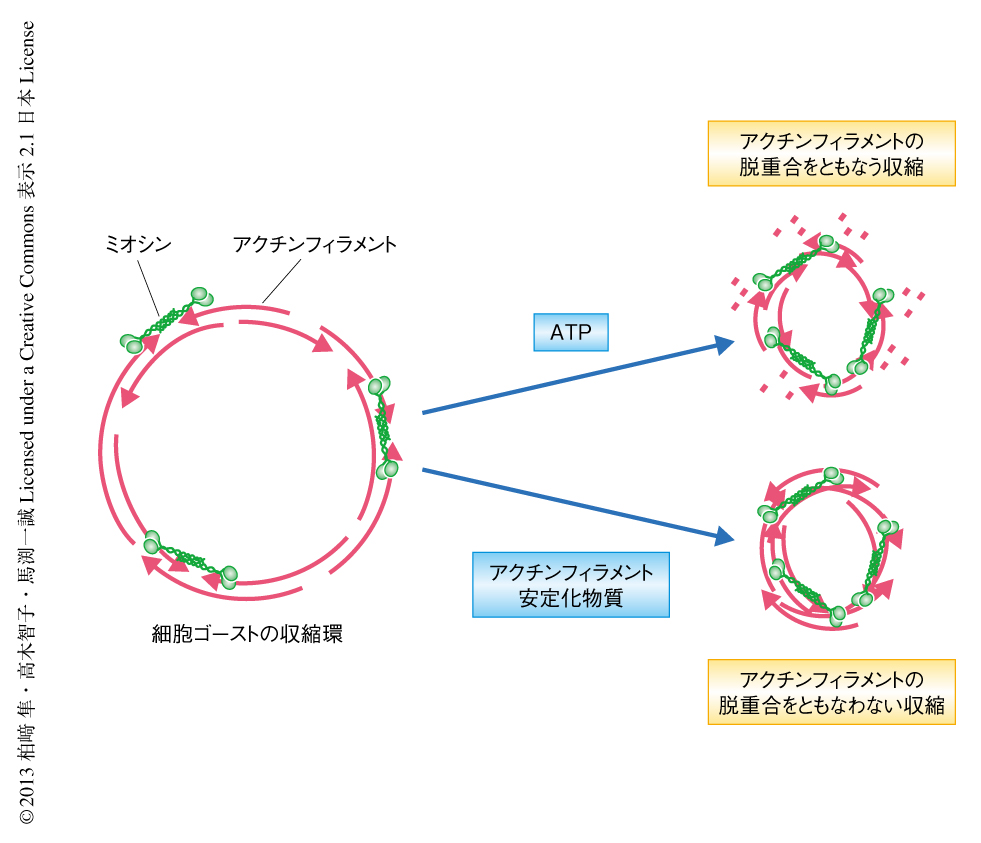



In Vitroにおける収縮環の収縮はミオシンiiに依存するがアクチンのダイナミクスには依存しない ライフサイエンス 新着論文レビュー
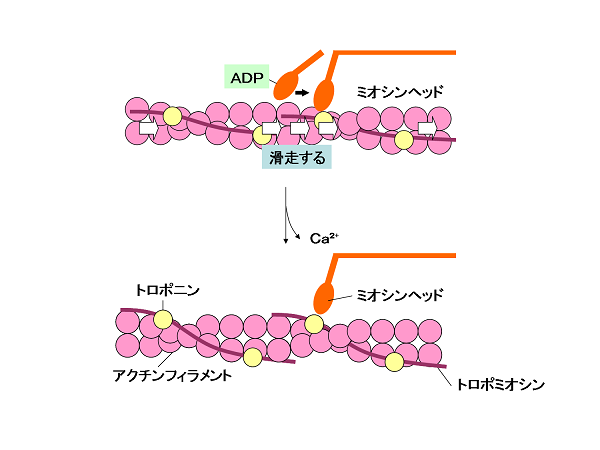



細胞内のタンパク質 モータータンパク質 バイオハックch



動く生き物大辞典 サルコメア




筋収縮はどのようなメカニズムで収縮するのか 痛み取り専門 楽楽痛み研究会 公式サイト
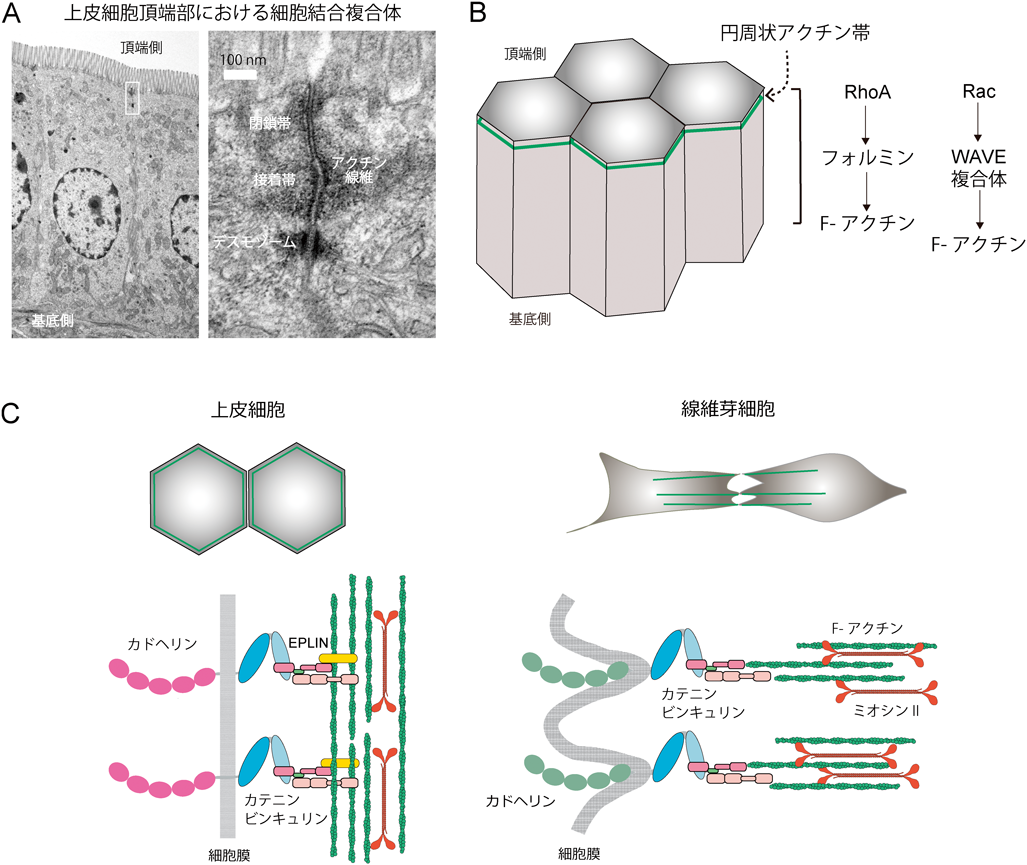



細胞間接着装置の仕組みを探る



Fig1 Html Spring 8 Web Site



美味しいサイエンス サイエンスカフェ Demems ディーメンズ サイエンスカフェ Demems ディーメンズ




筋トレの分子生物学 5 アクチンとミオシン タイチン Hymn
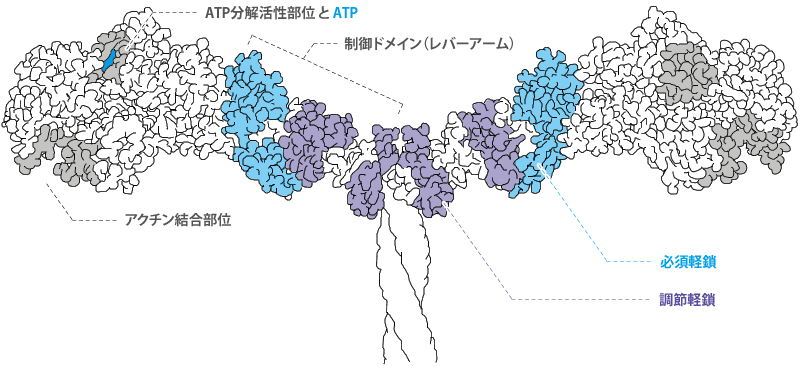



筋のタンパク質 アクチン ミオシン
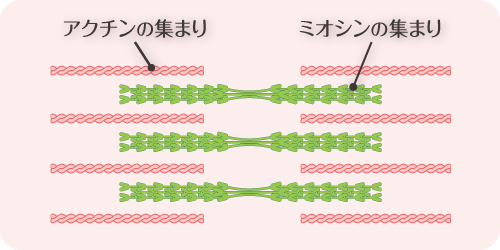



ハンバーグを作るときによくこねるのはなぜ Z Square Z会




骨格筋の構造 動く 3 看護roo カンゴルー
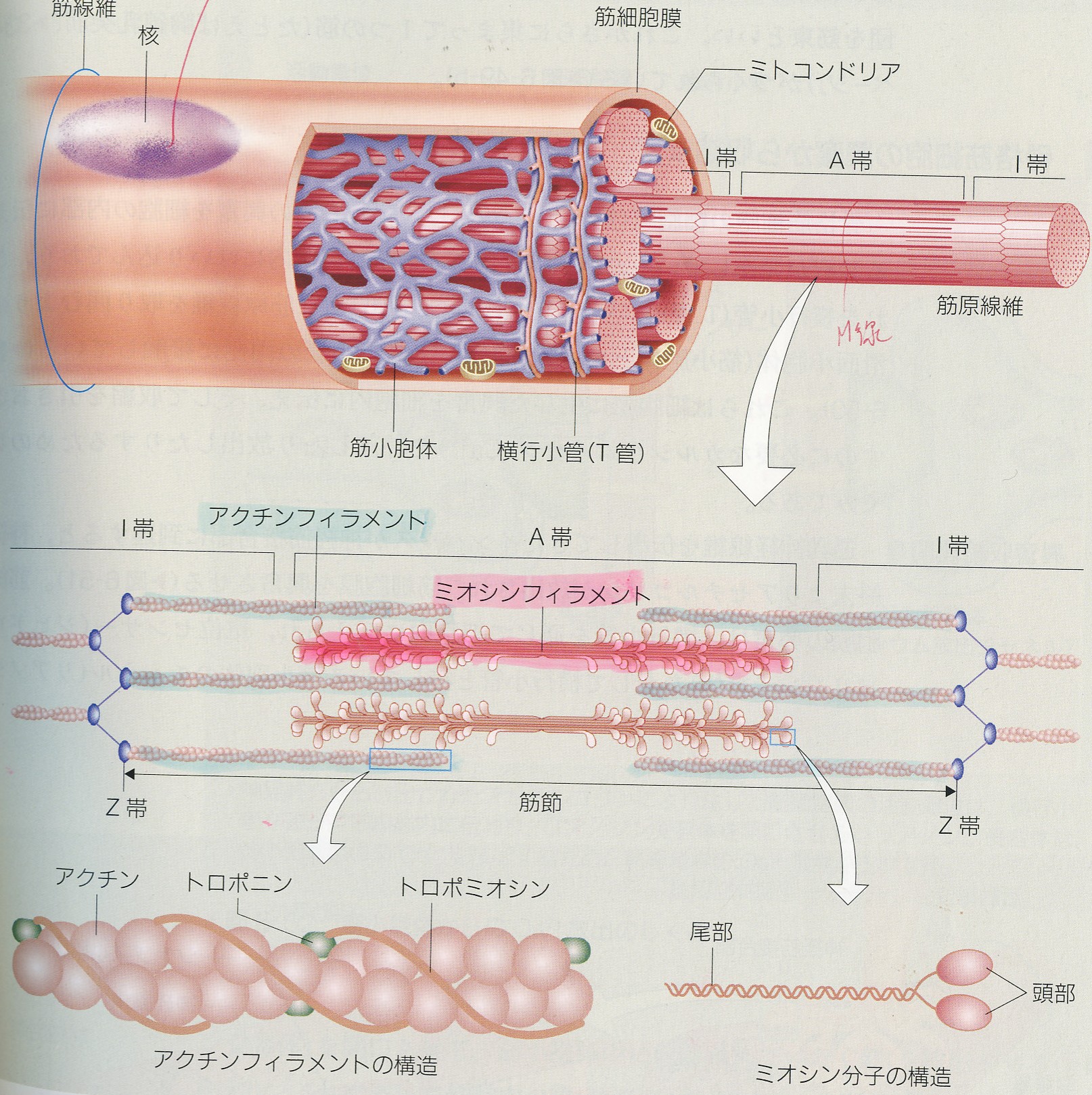



居合と科学 筋収縮 12 富山de居合 無涯塾日記
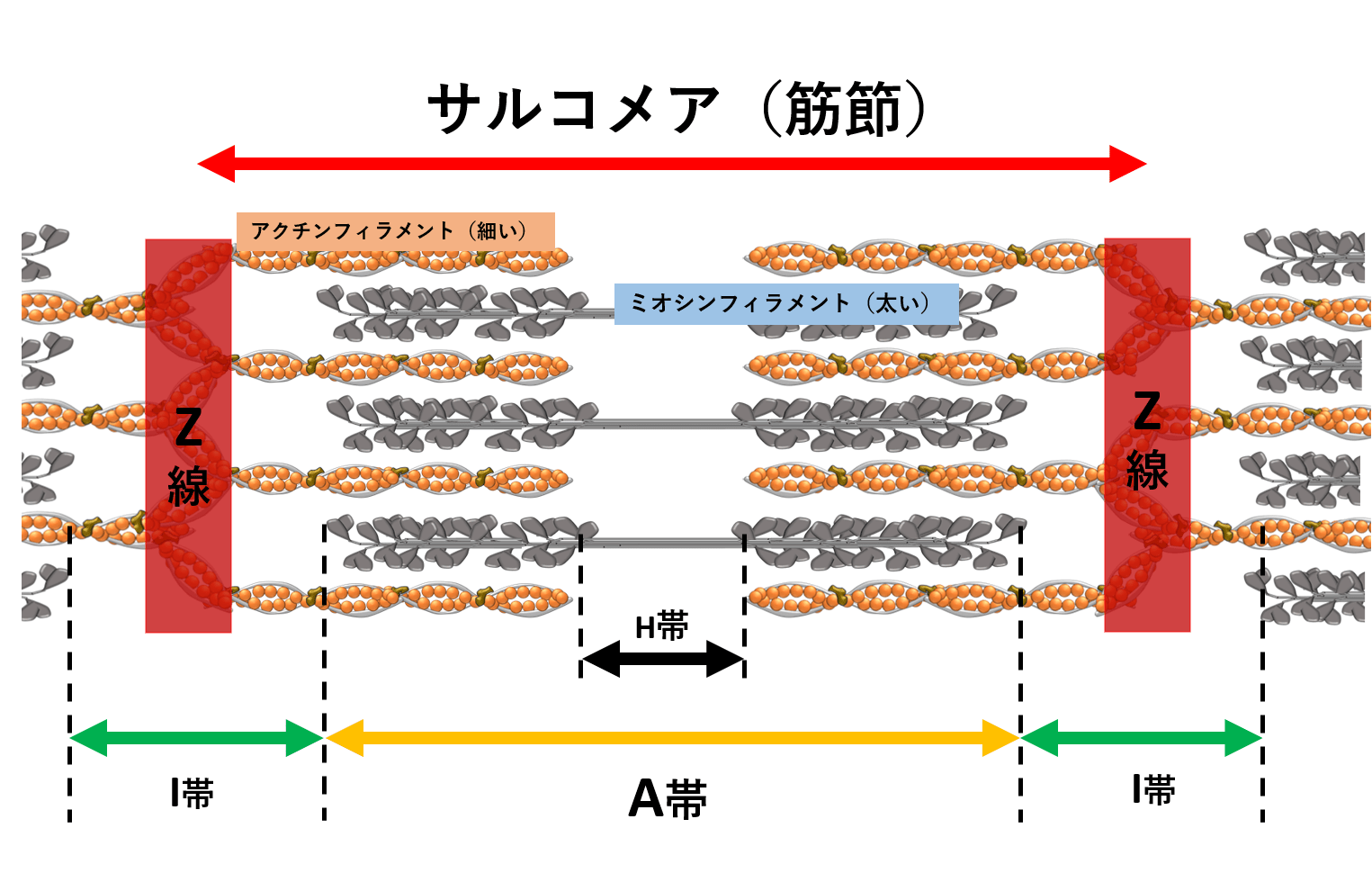



分かりやすい 筋線維の構造 筋原線維 筋小胞体 アクチンとミオシン 陸上競技の理論と実践 Sprint Conditioning
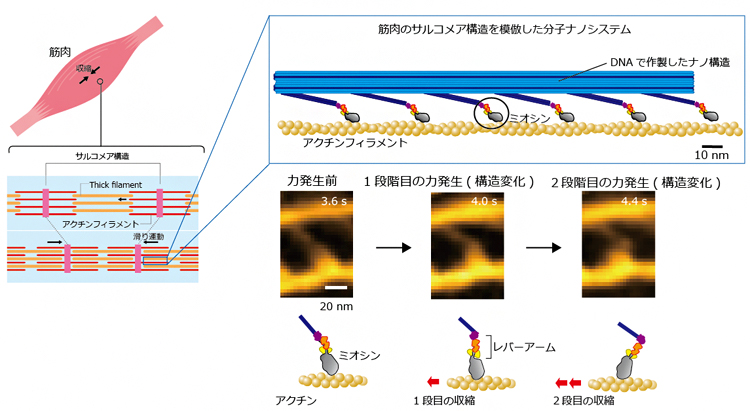



分子ナノシステムの設計から筋収縮の原理を解明 理化学研究所




筋肉が高エネルギー効率である仕組みを分子レベルで解明 プレスリリース 東京大学 大学院理学系研究科 理学部
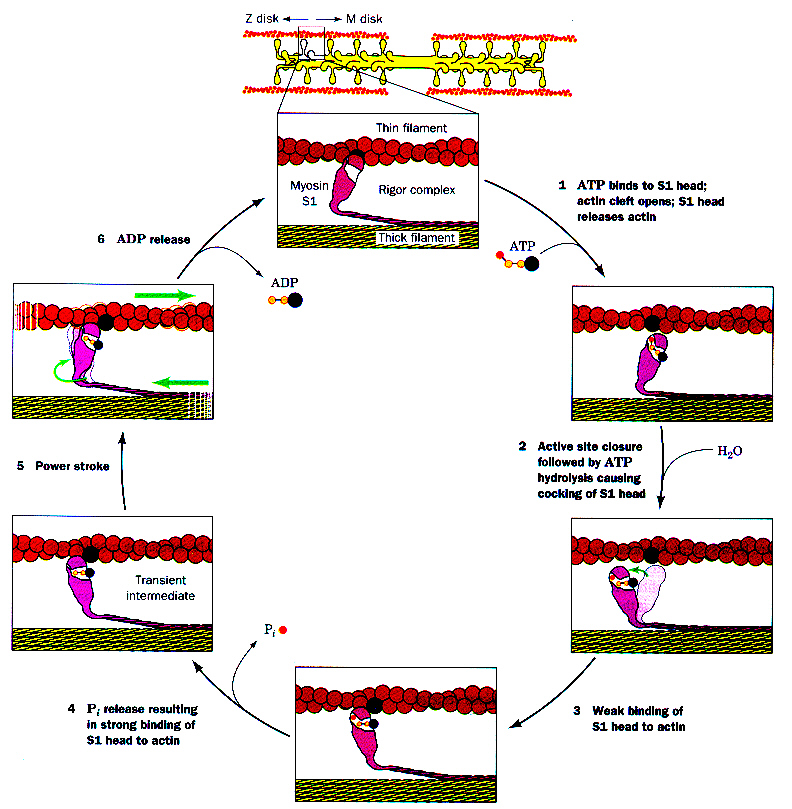



Signal



1




Sprint Conditioning 筋収縮の仕組み ミオシンとアクチンの覚え方 スポーツ生理学の授業でも 覚えにくいが故にあまり人気があるとは言えない内容 筋収縮の仕組みと 簡単な覚え方を紹介します しょうもないですが T Co X2achpkbin



新着細胞生物学用語集 アクチン ミオシン 一般社団法人 日本細胞生物学会



新着細胞生物学用語集 筋細胞 一般社団法人 日本細胞生物学会



1
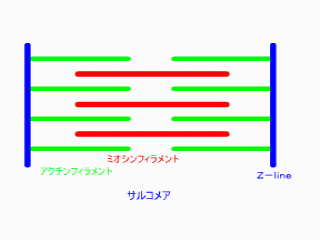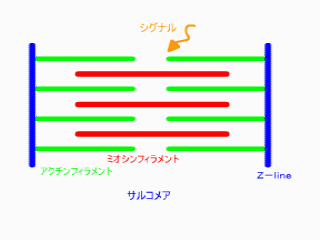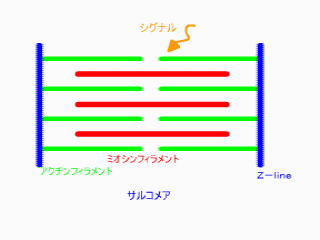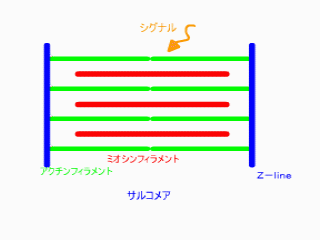



無題ドキュメント




筋肉の動き 予防医学センター臨床疫学藤田伸輔




興奮収縮連関 Explore Facebook




プレスリリース Mast21 東北大学 マテリアル 開発系



迷作リメイクシリーズ104 我ら妄想族 毒にも薬にもならない話4 ニヤッとする話




骨格筋の収縮メカニズム アクチン ミオシン Web系エンジニアを医学生が目指してみる



名古屋市科学館 科学館を利用する 展示ガイド フロアマップ 骨と筋肉 筋肉の収縮




骨格筋の収縮と弛緩 Study Channel
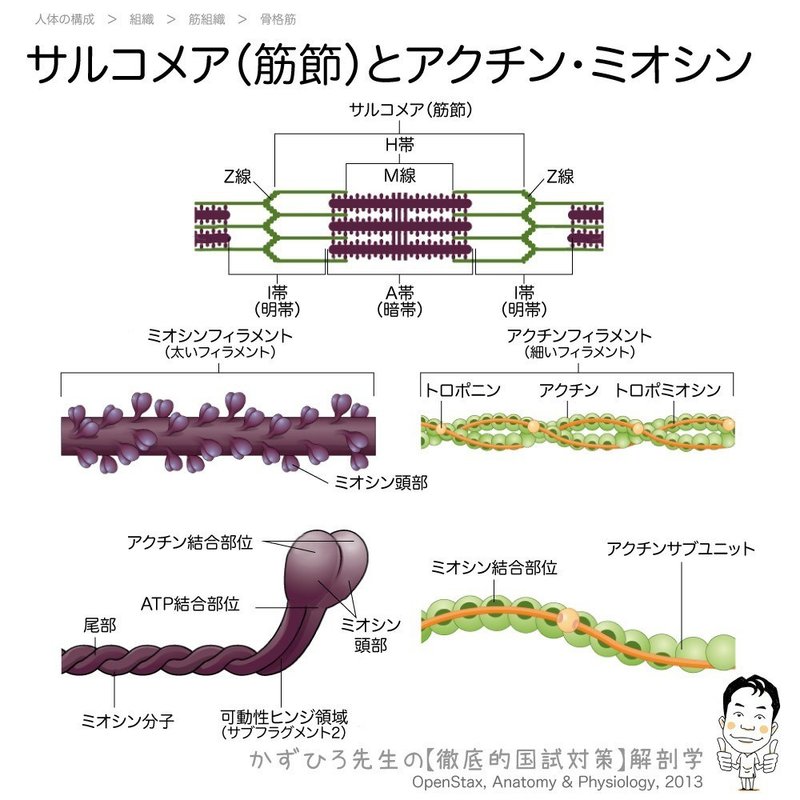



1 2 8 筋組織 解説 マガジン記事 黒澤一弘 Note
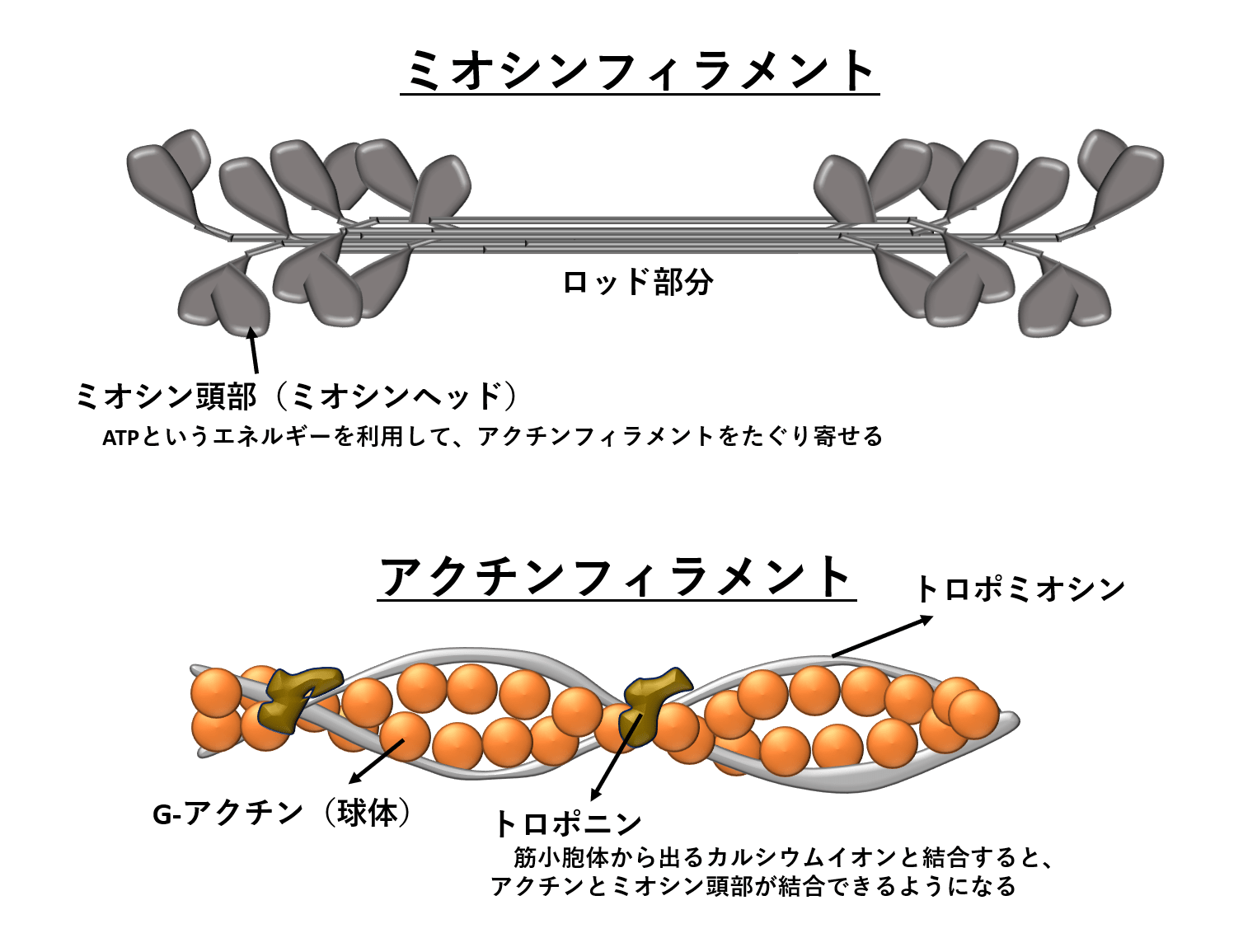



分かりやすい 筋線維の構造 筋原線維 筋小胞体 アクチンとミオシン 陸上競技の理論と実践 Sprint Conditioning




臨床運動学2 筋と神経の基礎 作業療法的見聞録 一般社会人からの転職組otが思う事
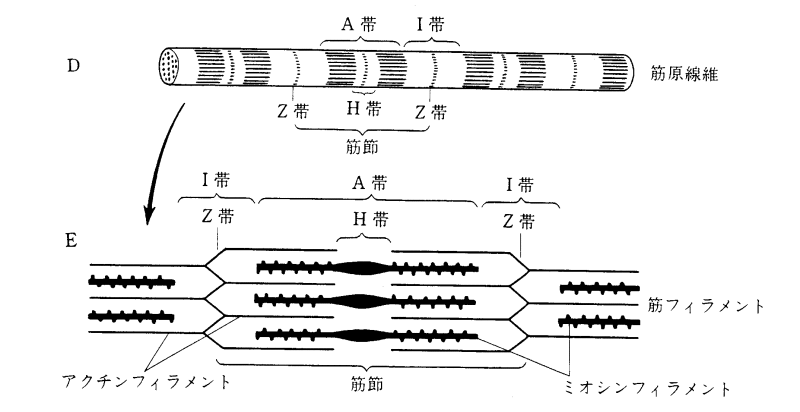



ミオシンとアクチンどちらが太い 重 巻き肩 脱力で人生は好転する




筋の収縮のメカニズム 骨格筋の機能 看護roo カンゴルー




生体を動かすタンパク質



Udruk51uy4d9ovrfkg1bb58e Biz Archives 774



0 件のコメント:
コメントを投稿